国际顶级学术期刊Nature于北京时间2017年5月18日01时以长文(Ariticle)形式报道了我校基础医学院青年教师杨琳琳参与的首个全长B型G蛋白偶联受体(G-protein coupled receptor,GPCR)晶体结构及活化调控机制研究(http://www.nature.com/nature/journal/vaop/ncurrent/full/nature22363.html),杨琳琳老师为该论文的共同第一作者。
这项研究是与中国科学院上海药物研究所吴蓓丽、王明伟和蒋华良分别领衔的三个课题组合作完成的,首次测定了胰高血糖素受体(Glucagon receptor,GCGR)全长蛋白的三维结构并揭示了该受体不同结构域对其活化的调控机制。该成果有助于人们深入认识GPCR超家族蛋白结构与功能的关系,为2型糖尿病治疗新药的开发提供了新的思路。
GPCR是人体内最大的膜受体蛋白家族,由800多个成员组成,在细胞信号转导中发挥重要作用。GPCR与人类疾病关系密切,是最大的药物靶标蛋白家族,目前40%以上的上市药物以GPCR为靶点。GCGR属于B型GPCR,参与调节体内血糖稳态,是治疗2型糖尿病的重要靶点。由于其结构信息的缺失,不仅限制人们对GCGR与其天然配体和小分子拮抗剂相互作用机制的理解,也影响了靶向该受体的药物研发¾目前尚无上市药物。
最近,中国科学院上海药物研究所的吴蓓丽、王明伟和蒋华良等三个课题组联手国际伙伴,通过多学科的紧密合作与艰苦攻关,成功解析了全长GCGR蛋白同时与一种小分子变构调节剂(NNC0640)和拮抗性抗体(mAb1)抗原结合片段结合的复合物晶体结构。基于全长GCGR的三维结构,杨琳琳运用分子动力学模拟(MD)方法研究了全长GCGR不同结构域之间的作用模式及动态改变,阐明可能影响受体功能的构象变化,与一系列功能研究结果吻合。
研究发现,GCGR连接胞外和跨膜结构域的肽段stalk通过其构象变化在受体活化调控中扮演关键角色。该连接肽通过与跨膜结构域的胞外环区相互接触,并和胞外结构域紧密结合,将受体的分子构象稳定在非活化状态;而当GCGR的胞外结构域与多肽配体结合时,该连接肽与受体其他区域分离,通过可能发生的二级结构转变促使胞外和跨膜结构域之间相对构象产生变化,从而协助多肽配体与跨膜结构域紧密结合,最终导致受体激活。
参与这项研究的还有中国科学院上海药物研究所赵强研究员、杨德华副研究员、研究生张浩楠和乔安娜,以及上海科技大学Raymond Stevens教授等。来自荷兰、丹麦和美国等地的研究人员以多种方式提供了支持和帮助。国家科学技术部、国家卫生和计划生育委员会、国家自然科学基金委员会、中国科学院、上海市科学与技术发展基金、GPCR联盟和美国国立卫生研究院资助了科研经费。

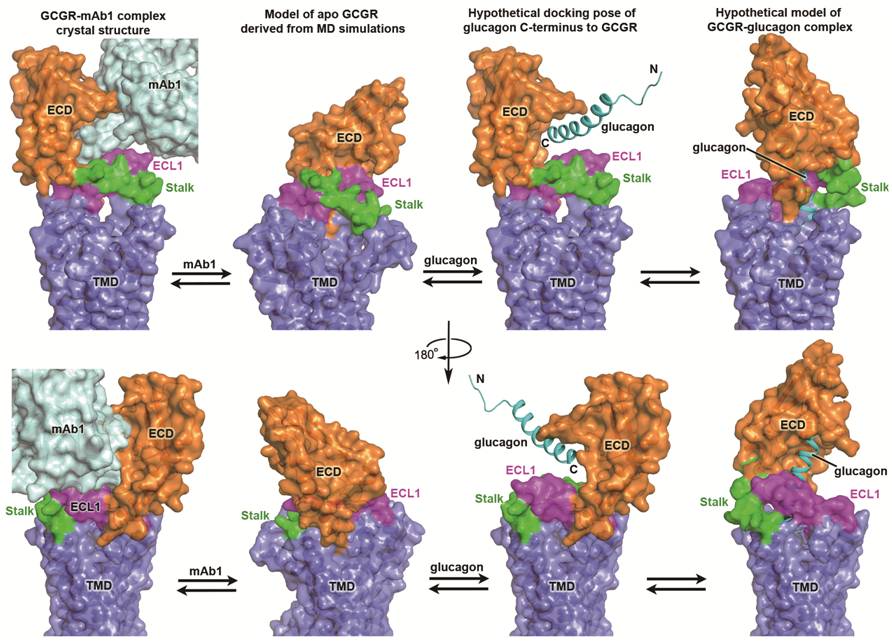
计算模拟和功能实验所揭示的全长GCGR的不同构象。图中上下两行分别从不同视角展示了全长GCGR的四种不同构象:GCGR-mAb1复合物晶体结构、分子动力学模拟产生的空载GCGR构象、配体glucagon的C端与全长GCGR的对接模型和GCGR-glucagon复合物模型,每一行中GCGR跨膜区(TMD)的视角保持一致。GCGR-glucagon复合物模型中,stalk区域发生了明显的构象改变,可能伴随着它与胞外第一个柔性环ECL1相互作用的消失以及自身二级结构的变化。为了清晰,所有的结构和模型只显示了蛋白表面:GCGR的胞外区(ECD)、stalk、ECL1和TMD分别用橘色、绿色、枚红色和蓝色表示,抗体mAb1用青色表示。多肽配体glucagon用青色卡通形式表示。




