红细胞是人体血液中数量最多的血细胞,在机体生命活动的维持中起到非常重要的作用。红系发育是一个复杂且精细的多阶段过程。在这个过程中伴随着一系列特征性的生物学事件,包括细胞体积减小、细胞核固缩、染色质凝缩、血红蛋白合成增加以及脱核等[1,2]。红系发育过程任何一个阶段的异常都能导致疾病的发生。越来越多的研究表明,表观遗传修饰在红系发育中发挥着关键作用,表观遗传调控因子的功能异常与红系发育障碍相关疾病的发生密切相关[3]。EZH2是Polycomb Repressive Complex 2(PRC2)复合体的催化亚单位,作为甲基转移酶介导组蛋白H3第27位赖氨酸的三甲基化修饰(H3K27me3)。尽管已有研究证明EZH2在造血发育过程中发挥了重要作用[4],但目前对于红系发育进程中EZH2的作用和机制尚且缺乏深入的了解。

近日郑州大学生命科学学院陈鲤翔教授团队和纽约血液中心安秀丽教授团队合作在Haematologica发表题为“Stage-specific dual function: EZH2 regulates human erythropoiesis byeliciting histone and non-histone methylation”的研究论文,该研究首次报道了EZH2通过催化组蛋白和非组蛋白的甲基化,以阶段特异性的的双重功能调节人类红细胞生成。
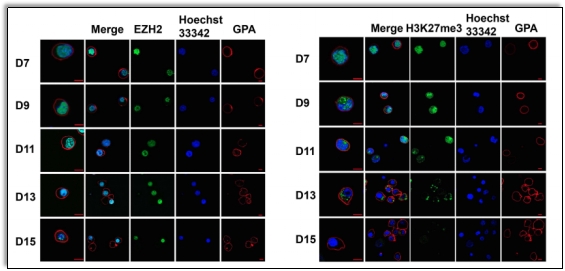
首先研究人员通过对红系发育过程各阶段中EZH2及其催化产物H3K27me3的定位与丰度进行分析,发现在整个红系发育过程中,EZH2始终定位在细胞核中,并持续表达;但H3K27me3的分布和丰度在红系发育过程中呈现动态变化,在早期阶段定位于细胞核中,而在终末阶段中随着分化的进行,渐次从细胞核中释放,丰度持续降低(图一)。而这一发现提示EZH2可能以依赖或非依赖于H3K27me3的阶段特异性方式调控红系发育过程。
|
图一正常红系发育过程中EZH2和H3K27me3的定位情况
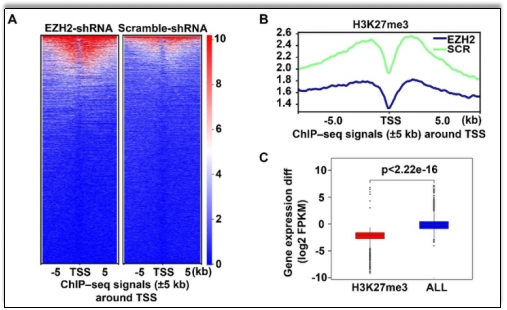
研究人员首先成功构建了体外EZH2缺失的人异常红系发育模型。通过分析发现,在红系发育早期阶段,EZH2功能缺失导致细胞周期阻滞在G1期,从而影响红系祖细胞的增殖和分化。随后,研究人员进一步利用基于H3K27me3的ChIP-seq和RNA-seq分析进行机制探索。结果发现,EZH2缺失导致H3K27me3丰度下降,进而导致细胞周期蛋白依赖性激酶抑制相关基因表达上调(图二)。
|
图二ChIP-seq结果显示敲低EZH2导致H3K27me3丰度下降
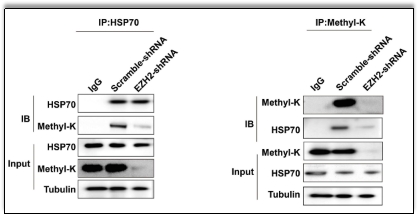
在红系发育终末阶段,EZH2功能缺失导致细胞核形态异常、脱核效率降低。机制研究发现,EZH2以不依赖于H3K27me3的方式催化非组蛋白HSP70的甲基化。EZH2缺失引起HSP70的甲基化水平下降,进而导致AURKB表达下调,最终终末阶段细胞功能异常(图三)。
|
图三敲低EZH2导致HSP70甲基化降低
综上所述,该研究揭示了EZH2通过介导组蛋白和非组蛋白甲基化,以阶段特异性的双重功能调节人类红细胞生成,并深入阐释其在不同发育阶段的作用机制。该研究为阐明EZH2在人类红细胞生成过程中的调节机制提供了新的见解,对理解EZH2功能障碍相关的红系异常性疾病的发病机制具有重要意义。
郑州大学生命科学学院李梦佳博士(现就职于郑州大学第一附属医院)为第一作者,刘栋浩博士和河南省儿童遗传代谢性疾病重点实验室薛福敏主治医师为共同第一作者。郑州大学生命科学学院陈鲤翔教授和美国纽约血液中心安秀丽教授为共同通讯作者。本研究工作得到国家自然科学基金委项目和河南省高校科技创新人才支持计划的资助。研究工作得到中南大学生命科学学院刘静教授课题组的大力支持
原文链接:
https://doi.org/10.3324/haematol.2022.282016
参考文献:
1. Hu, J., et al., Isolation and functional characterization of human erythroblasts at distinct stages:implications for understanding of normal and disordered erythropoiesis in vivo. Blood, 2013.121(16): p. 3246-53.
2. Mei, Y., Y. Liu, and P. Ji, Understanding terminal erythropoiesis: An update on chromatin condensation, enucleation, and reticulocyte maturation. Blood Rev, 2021. 46: p. 100740.
3. Hewitt, K.J., et al., Epigenetic and genetic mechanisms in red cell biology. Curr Opin Hematol, 2014.21(3): p. 155-64.
4. Kheradmand Kia, S., et al., EZH2-dependent chromatin looping controls INK4a and INK4b, but not ARF, during human progenitor cell differentiation and cellular senescence. Epigenetics Chromatin, 2009.2(1): p. 16.