2022年6月7日,我院陈松教授团队和中国科学技术大学吴缅教授团队合作在EMBO Journal在线发表了题ULK1-mediated Autophagy and Promote Tumorigenesis的研究论文,发现TRIM27是一个新的自噬负调控因子,可调控基础水平及营养缺失条件下自噬的起始,促进肿瘤发生,并在恶性肿瘤背景下抑制肿瘤的转移。

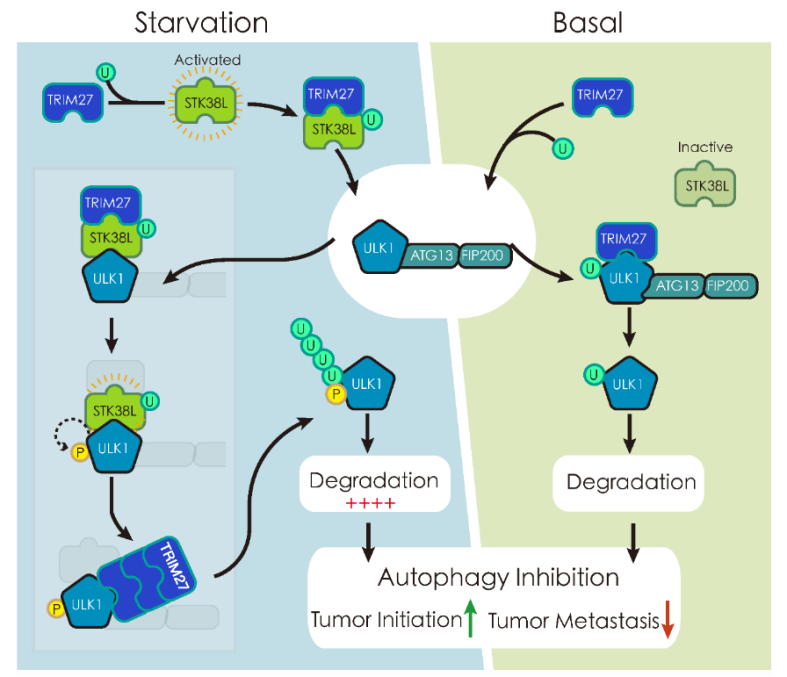
为了进一步阐明哺乳动物自噬起始的精确调控机制,研究人员首先通过质谱鉴定出一系列ULK1复合体的潜在调控因子,其中发现TRIM27可以直接结合ULK1并通过促进ULK1 K568和K571位点的K48连接的多聚泛素化修饰进而介导其蛋白酶体途径的降解,从而调控基础水平(basal level)的自噬。进一步研究发现在饥饿条件(nutrient starvation)下,TRIM27可以促进STK38L K181,K215,K224,K432和K434位点的K6连接的多聚泛素化修饰从而激活丝氨酸/苏氨酸激酶STK38L,被激活的STK38L催化ULK1 S495位点的磷酸化修饰,从而更加高效地促进TRIM27介导的ULK1的泛素化修饰和其蛋白酶体途径的降解,进而能够在营养条件缺失下限制自噬水平的过度增加,最终维持细胞稳态。
在生理水平上,研究人员发现Trim27基因敲除导致小鼠体内的基础自噬水平显著增加,同时抑制自发性乳腺癌的MMTV-PyMT小鼠乳腺肿瘤的发生。研究者在小鼠原发肿瘤出现3周后分析了PyMT小鼠的肺转移情况。研究者意外地发现相比野生型对照,Trim27敲除小鼠中转移灶的数量和整体肺部肿瘤负荷显著增加。
研究者进一步通过三维成球培养实验在3D水平下评估了Trim27敲除所引起的自噬水平的上升对PyMT肿瘤细胞生长的影响,结果发现ULK1小分子抑制剂、以及敲低自噬核心蛋白Atg5,Atg7均能显著抑制乳腺肿瘤在体外3D培养中的生长。同时,体内实验表明,小分子药物化合物靶向抑制ULK1能显著抑制了4T1乳腺肿瘤的肺转移。这些结果进一步证实靶向自噬能够抑制肿瘤发生后的生长及转移。
综上所述,该研究揭示了E3连接酶TRIM27在自噬调节中的作用,既可以维持细胞基础水平自噬,也可以在饥饿条件下抑制细胞的过度自噬,后者需要TRIM27与丝氨酸/苏氨酸激酶STK38L之间的协同作用。生理意义层面,该研究揭示了TRIM27-ULK1信号轴作为抑制肿瘤发生的潜在干预靶点,并为开发以自噬为靶点的针对不同阶段肿瘤进行干预的个性化治疗策略提供了新的思路。
论文的通讯作者为郑州大学陈松教授及中国科学技术大学吴缅教授和刘连新教授。中国科学技术大学博士研究生杨义和朱逸夫是论文的共同第一作者。这项工作得到了美国辛辛那提大学管俊林教授,华南理工大学温龙平教授,南京医科大学附属南京医院韦栋平研究员的大力支持。
原文链接:https://www.embopress.org/doi/abs/10.15252/embj.2021109777