哺乳动物成熟的红细胞是没有细胞核的。作为哺乳动物红系发育特有的生物学现象,哺乳动物的红细胞需要在终末分化的晚期将极化的细胞核排出。作为物种进化的产物和证据,红细胞的脱核被认为可以为红细胞更有利地发挥功能提供特殊的生理意义;此外,脱核障碍作为重要的瓶颈,也一直制约着人们利用干细胞高效产生功能性红细胞用于临床输血。因此,对红细胞脱核过程及其调控机制的深入研究具有重要的理论和现实意义。
近日,郑州大学生命科学学院张世杰团队与纽约血液中心安秀丽教授合作在《Haematologica》期刊上发表题为《A novel role of AURKA kinase in erythroblast enucleation》的研究论文。该研究创新性地发现Aurora A激酶在红细胞脱核过程中具有独特的时空变化,并揭示了其通过调控中心体成熟和ECT2降解来控制细胞核的极化和脱核过程。本发现促进了对红细胞脱核过程的理解,并为相关机制提供了新的见解。
本研究发现在红细胞逐渐退出细胞周期、即将脱核的过程中,AURKA呈现高表达。由于Aurora激酶通常在快速分裂的细胞和组织中高水平表达,这提示AURKA可能在红细胞脱核过程中扮演了新的角色。为验证AURKA在红细胞脱核中的作用,研究团队使用AURKA选择性抑制剂以及siRNA处理红细胞,结果发现抑制AURKA显著降低了红细胞的脱核率。
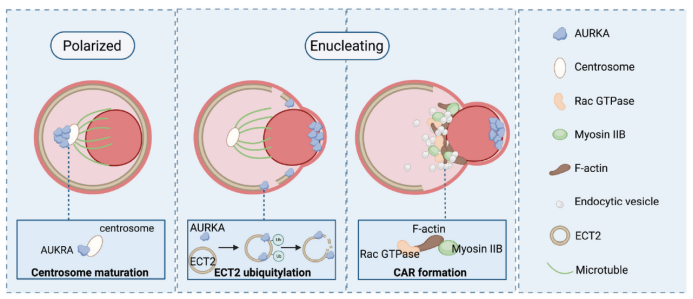
随后,利用高分辨率共聚焦显微镜,研究者发现AURKA在非极化红细胞中呈弥散分布,在红细胞极化时则与中心体共定位于细胞核的后端。研究也揭示了AURKA通过调控中心体的成熟来控制细胞核的极化。有趣的是,本研究发现在随后的脱核过程中,Aurora A则脱离中心体转移到突出核的前端。这一动态变化提示AURKA可能在细胞核极化和随后的核排出过程中扮演着不同的调控角色。
进一步研究表明,AURKA调控了红细胞脱核过程中Rho GTPase鸟苷酸交换因子ECT2的表达和定位。ECT2在非极化和极化红细胞中弥散分布,但在正常脱核过程中则集中在细胞核的后端。而AURKA的失活会导致ECT2定位的改变,从而影响红细胞的脱核过程。深入研究发现AURKA可以与ECT2直接互作并通过发挥泛素化功能促进ECT2的泛素化降解,并且此泛素化功能依赖于蛋白的激酶活性。最后,敲低ECT2基因能够部分恢复AURKA失活引起的脱核障碍。
总之,研究团队创新性地展示了AURKA在脱核过程中具有的时空定位的动态变化,并证明了AURKA通过与γ-微管蛋白和ECT2相互作用,控制中心体定位和ECT2降解,从而促进核极化和细胞核排出。本研究最终提出全新的红细胞脱核模型(如图2)。球形晚幼红细胞在退出细胞周期后,以AURKA调控的中心体为“信标”确定极化方向,然后凝缩的细胞核在微管形成的单极纺锤体的作用下向细胞一侧移动。随后,AURKA易位到突出核的前端,直接降解ECT2,形成不对称收缩力,为脱核过程提供力量。在Rac GTPases的控制下,F-actin与myosin IIB相互作用,在裂解沟中聚合形成收缩环,完成细胞核与网织红细胞的最终分离。在这个转移过程中,内吞囊泡移动并在分裂面融合以提供额外的质膜。
郑州大学博士后徐原林、博士研究生贾培君和已毕业硕士研究生李亚庭为该论文的共同第一作者,郑州大学生命科学学院张世杰和美国纽约血液中心安秀丽教授为共同通讯作者,郑州大学生命科学学院为第一通讯单位。郑州大学生命科学学院张欢副研究员、张晶鑫副教授为本研究提供了重要帮助。研究得到了国家自然科学基金、河南省优青项目、河南省高校科技创新人才项目等多项资助的支持。

