
近年来,纳米酶催化医学作为新兴交叉学科,正在推动多病种精准催化治疗从“概念”走向“临床可达”。 近期,郑州大学基础医学院/中原纳米酶实验室研究团队开发了一种新型纳米酶滴眼剂,实现了通过无创滴眼方式高效递送纳米酶至眼底视网膜,并在小鼠模型中显著改善病理性血管异常。这一成果为视网膜血管病变的无创治疗提供了全新的解决方案。
视网膜新生血管病(如糖尿病视网膜病变、早产儿视网膜病变、湿性老年黄斑变性)是全球致盲的重要原因。这类疾病与氧化应激和异常血管生成密切相关。现有临床治疗主要依赖玻璃体腔反复注射抗VEGF药物,虽然该方法在部分患者中能抑制病变进展,但其疗效存在局限,部分患者反应不佳或出现耐受性。与此同时,该方式具有高度侵入性,患者依从性差,并伴随感染和出血等风险。因此,视网膜病变治疗的科学问题既在于如何开发新型有效的治疗策略,也在于如何突破眼部屏障实现安全高效的药物递送。纳米酶因具备类天然酶的催化活性,被认为有潜力通过清除ROS改善局部微环境,从而抑制新生血管生成,但其在眼科疾病治疗中的疗效尚缺乏充分验证。同时,角膜和血–视网膜屏障则是药物递送至眼底的关键障碍,如何实现无创、精准的递送也是长期存在的技术难题。
针对上述问题,研究团队开发了一种新型纳米酶滴眼剂 FR-PolyRu。FR-PolyRu纳米酶滴眼剂由氟化和RGD修饰的脂质体外壳与内部的PolyRu纳米酶组成。氟化修饰能够降低纳米酶跨膜所需的活化能,显著提升脂质体在角膜和血–视网膜屏障中的穿透性;纳米酶的催化反应可在局部产氧,为药物跨屏障转运提供驱动力; RGD修饰赋予血管靶向能力,使纳米酶在病灶区高效聚集并精准作用。在进入眼底后,FR-PolyRu 纳米酶依托其超氧化物歧化酶(SOD)和过氧化氢酶(CAT)级联活性,可持续清除活性氧(ROS),缓解氧化应激,改善局部微环境,从而抑制异常血管生成。在小鼠氧诱导性视网膜病变模型中,FR-PolyRu 滴眼治疗显著减少了无灌注区和新生血管面积,并降低视网膜细胞凋亡水平。转录组学分析进一步揭示,FR-PolyRu通过调控Igfbp6/PI3K/AKT等信号通路参与病理血管生成的调节。
相关研究成果以“Nanozyme Eye Drops for Retinal Barrier Penetration and Vasculopathy Repair”为题,发表在国际权威期刊《Science Advances》上。郑州大学基础医学院江冰副教授、姜伟副教授和阎锡蕴院士为本文共同通讯作者,基础医学院薛白副研究员、王淑雨博士为论文共同第一作者。该研究得到国家自然科学基金等项目资助。
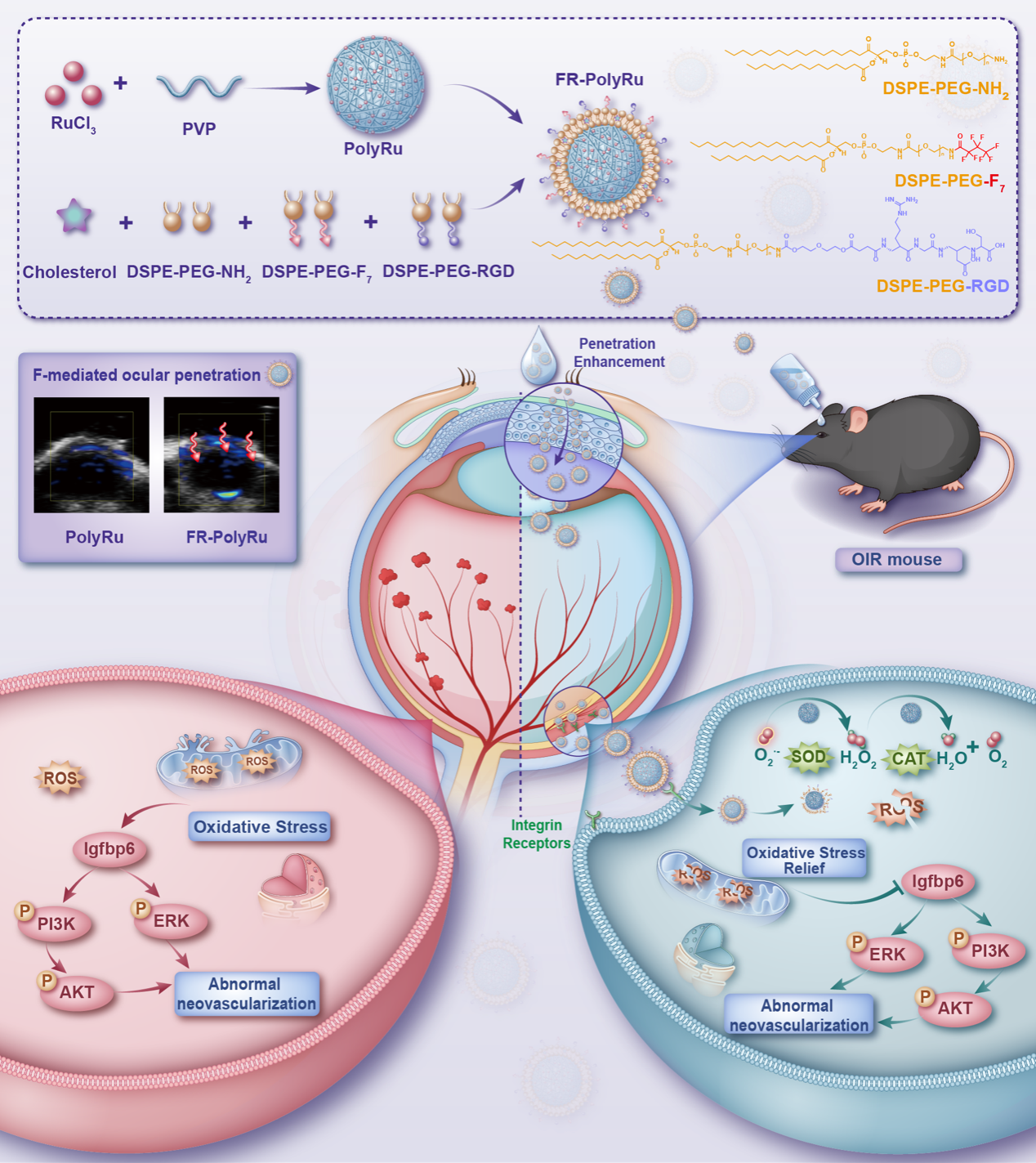
图1. FR-PolyRu纳米酶的合成过程及治疗效果示意图:PolyRu 纳米酶包裹于氟化和 RGD 修饰的脂质体中,可增强眼屏障的穿透性。该级联 SOD-CAT 纳米酶有效清除ROS,在体内外 OIR 模型中减轻氧化应激并抑制视网膜新生血管。转录组学分析进一步显示其通过抑制异常IGFBP6/PI3K/AKT信号通路,从而发挥抗血管生成作用。
文章链接:https://www.science.org/doi/10.1126/sciadv.adu5571