
肿瘤疫苗免疫治疗因其能够激发长期免疫记忆与抑制转移,被视为最具潜力的抗癌策略之一。然而,传统亚单位疫苗在体内递送与免疫激活环节仍存在瓶颈:其一,难以实现高效的淋巴结(LN)靶向与树突状细胞(DC)摄取;其二,细胞免疫应答不足,难以有效激活CD8⁺T细胞。纳米疫苗虽能部分改善递送,但“粒径—PEG修饰”的两难平衡仍限制了其免疫效能——小颗粒易引流却难滞留,大颗粒利于识别却不易进入LN。如何实现淋巴递送与免疫激活的协同调控,成为亟待解决的关键科学问题。
针对这一挑战,郑州大学基础医学院江冰副教授与阎锡蕴院士团队联合开发出一种具备“质子驱动形变–纳米酶催化”协同机制的智能纳米疫苗——PP@Pt-OVA。该策略通过动态形态转变与催化免疫放大双通路,实现了淋巴结精准递送与DC高效激活的一体化设计。
该纳米疫苗(PP@Pt-OVA)由具有过氧化物酶样活性的PVP@Pt纳米酶、疏水化抗原肽和pH响应共聚物PEG-b-PAE共组装而成。疫苗在中性环境下保持小尺寸和高PEG化,实现快速淋巴引流;在淋巴结弱酸环境中则发生质子化重组,颗粒尺寸增大、PEG层减少,从而增强树突状细胞(DC)摄取。与此同时,纳米酶催化产生活性氧(ROS),激活NF-κB信号通路,促进DC成熟和抗原交叉递呈。该体系实现了“递送–激活”的自适应协同,诱导显著的CD8⁺T细胞应答与免疫记忆。
在B16-OVA黑色素瘤模型中,PP@Pt-OVA表现出优异的预防和治疗效果,抑瘤率分别达到92.3%和85.5%,并能有效降低免疫抑制性细胞比例。该研究首次实现了质子驱动形变与催化免疫一体化设计,为构建可时空自调控的智能纳米疫苗提供了新思路,也为纳米酶在精准免疫治疗中的应用开辟了新的方向。
相关研究成果以“Proton-Driven Deformability Enables Nanozyme-Integrated Vaccine for Enhanced Tumor Immunotherapy”为题,发表在国际权威期刊《Advanced Materials》上。郑州大学基础医学院江冰副教授和阎锡蕴院士为本文共同通讯作者,基础医学院安静依副研究员和硕士生杨伊杰为论文共同第一作者。该研究得到国家自然科学基金等项目资助。
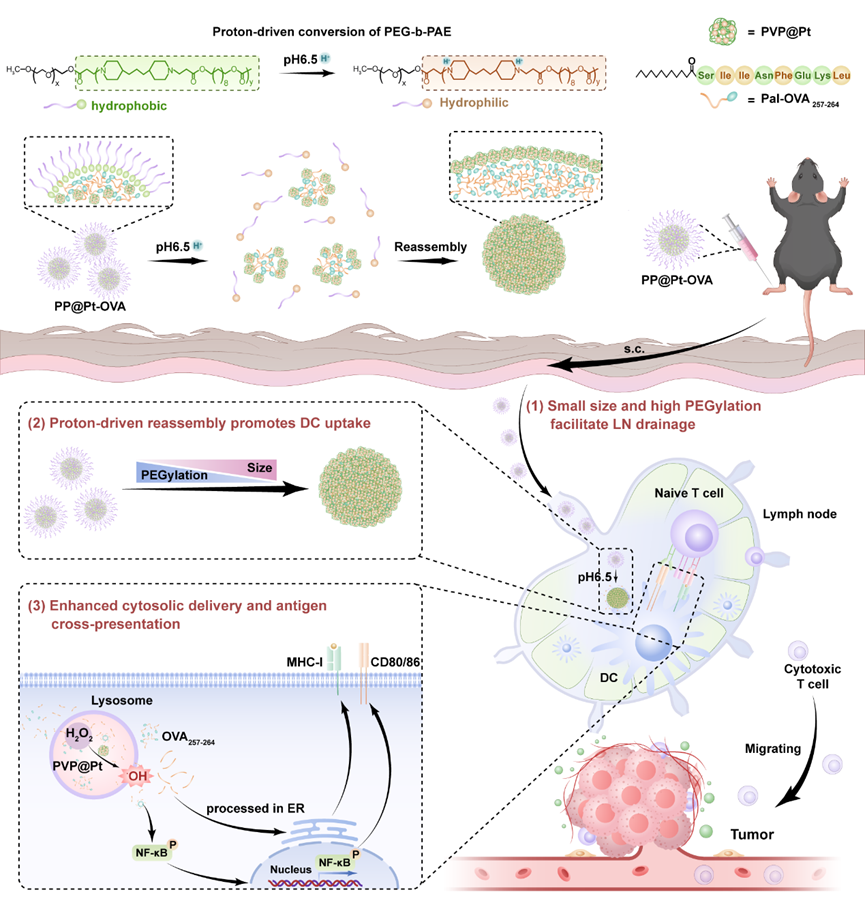
图1. PP@Pt-OVA纳米疫苗质子驱动形变及催化免疫激活示意图。
文章链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202509994