
近年来,纳米酶催化医学作为融合化学、材料与生命科学的新兴交叉领域,正推动精准治疗由“被动响应”向“智能调控”转变。纳米酶凭借其类天然酶的多功能催化特性、高稳定性与可工程化优势,在肿瘤、感染、代谢及神经退行性疾病等方面展现出广阔的应用前景。其中,在肿瘤光热治疗(PTT)领域,纳米酶可通过光热效应与催化反应的协同作用,实现对肿瘤微环境的动态调控。然而,传统PTT通常依赖高温(>50 °C)实现杀伤效应,易造成周围组织损伤。相比之下,温和光热治疗(mPTT,42-45 °C)因其低温、可控和生物安全性高的特点而受到关注,但其疗效受限于HSP70介导的热耐受效应。HSP70通过维持线粒体功能、稳定蛋白折叠和抑制细胞凋亡,使肿瘤细胞在亚致死温度下仍具较强生存能力,成为制约mPTT疗效的关键瓶颈。
针对这一问题,研究团队设计了温控响应型级联催化纳米酶系统(Ru-GOx-PNN),在低温光热条件下实现HSP70的精准、协同抑制。该体系在mPTT温度范围内可被激活,触发GOx-POD与GOx-CAT两条级联催化通路:前者生成羟基自由基(•OH),诱导脂质过氧化(LPO)并促进HSP70降解;后者通过葡萄糖消耗抑制ATP合成,从代谢层面下调HSP70表达。两条通路协同实现HSP70的“化学降解+代谢抑制”双重调控,有效削弱热耐受性,并解除其对JNK通路的抑制,促进JNK磷酸化及下游促凋亡信号激活,从而显著增强mPTT疗效。
与传统HSP70抑制剂或siRNA策略相比,Ru-GOx-PNN体系具备局部可控、按需激活和多酶协同放大的优势。传统策略往往存在选择性差、系统毒性高及体内稳定性不足的问题,而Ru-GOx-PNN通过近红外(NIR)光触发的温控机制,仅在局部加热区域释放催化活性,实现高效且安全的治疗效果。以食管鳞癌(ESCC)为模型的实验进一步验证了其优势:依托食管腔道的可达性与NIR精准照射,该体系在低温条件下实现高效抗肿瘤作用,同时展现优异的空间选择性与生物安全性。
综上,研究团队所构建的温控响应型Ru-GOx-PNN级联纳米酶,实现了光热触发、催化放大与信号调控的多重协同。在温和光热条件下通过双通路抑制HSP70并激活JNK通路,有效缓解热耐受并增强mPTT疗效,为低温光热治疗提供新的化学–生物协同调控思路,并为进一步探索级联催化纳米酶在肿瘤治疗中的应用提供参考。
相关研究成果以“Thermally Gated Dual-Cascade Nanozyme for Enhanced Mild-Temperature Photothermal Therapy”为题,发表在国际权威期刊《Advanced Science》上。郑州大学基础医学院江冰副教授、刘影副教授和阎锡蕴院士为本文共同通讯作者,基础医学院博士研究生王淑雨、王胜辉为论文共同第一作者。该研究得到国家自然科学基金等项目资助。
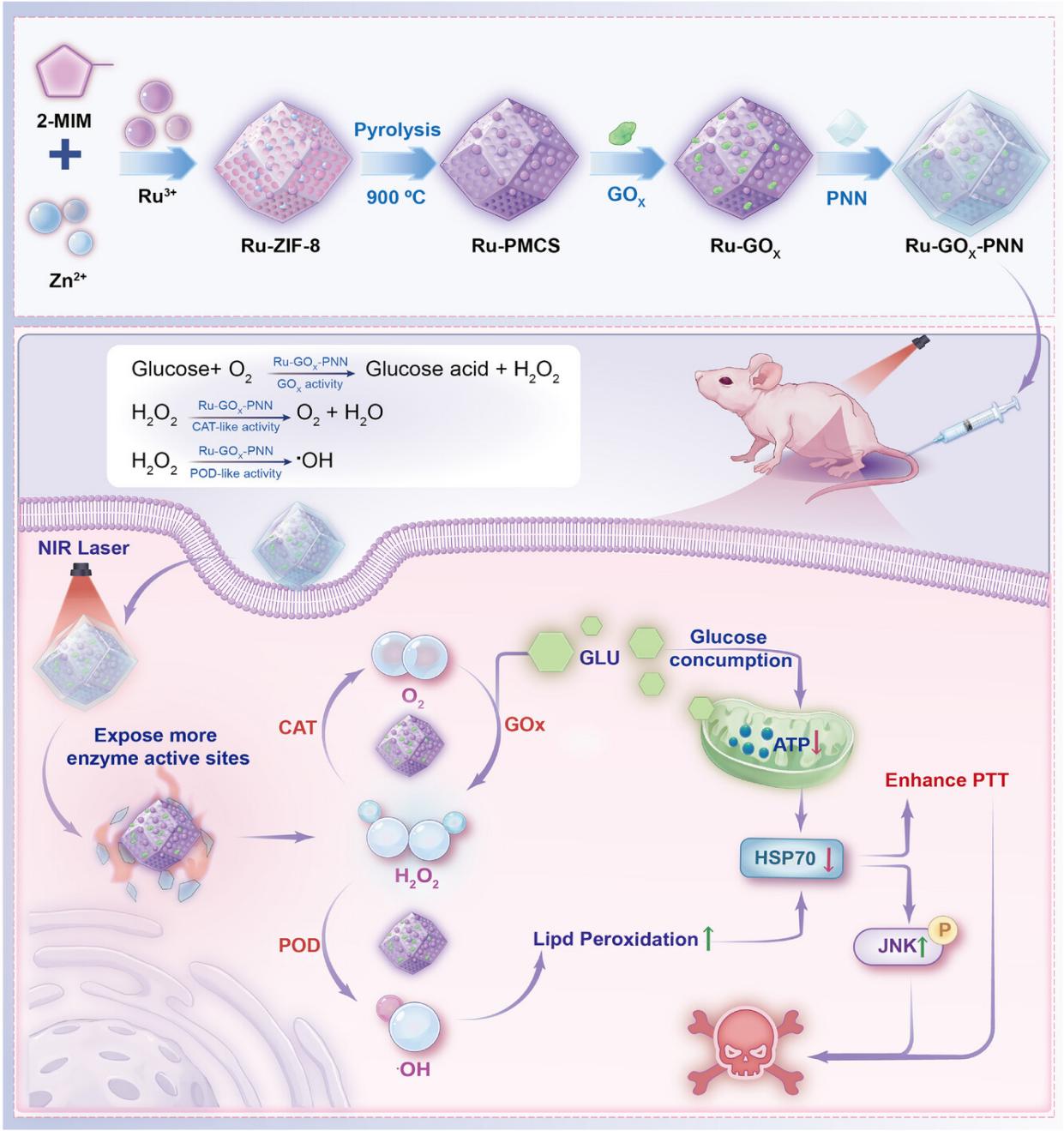
图1. 温控响应型Ru-GOx-PNN纳米酶系统用于增强温和光热治疗(mPTT)的示意图。在近红外(NIR)照射触发的低温光热条件下,表面包覆的温敏水凝胶(PNN)发生相变,暴露出更多酶的催化位点,从而激活级联催化反应。其中,GOx-POD级联产生•OH,诱导脂质过氧化并促进HSP70降解;GOx-CAT级联通过消耗葡萄糖抑制ATP合成,进一步下调HSP70表达。通过对HSP70的双通路抑制,有效缓解了细胞的热耐受性,并激活JNK信号通路,最终促进肿瘤细胞凋亡,显著提升温和光热治疗的疗效。
文章链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202517528